
University of Liège,
Pathology Tower (BC-3), Sart-Tilman, B-4000 Liège, BELGIUM
Phone : +32-4-366.72.75
Fax : +32-4-366.29.36

|
University of Liège, Pathology Tower (BC-3), Sart-Tilman, B-4000 Liège, BELGIUM Phone : +32-4-366.72.75 Fax : +32-4-366.29.36 |
Résumé de la thèse de doctorat en Sciences Biomédicales de Vincent LAMBERT défendue le 8 juillet 2005 à l'Université de Liège, Belgique
Ce travail a été réalisé au sein du
4.Chapitre 1: Rôle des Protéases à Sérine dans la Néovascularisation Choroïdienne [Lambert et al., 2001;Rakic et al., 2003;Lambert et al., 2003a]
1) Les signaux moléculaires impliqués dans le développement de néovascularisation choroïdienne ne sont pas actuellement bien connus. Parmi les facteurs de croissance, plusieurs indices suggérent une implication importante du VEGF (facteur de croissance endothélial vasculaire) dans la pathogenèse de la DMLA, depuis que d’une part, la présence de cette cytokine a été découverte dans certains échantillons pathologiques [Kvanta et al., 1996;Aiello et al., 1994], et que d’autre part, le VEGF est exprimé dans certains modèles de néovascularisation rétinienne induites par hypoxie [Pierce et al., 1995]. Malgré cela, la sur expression du VEGF seul est incapable d’induire la néovascularisation choroïdienne dans un modèle de souris transgèniques [Okamoto et al., 1997], suggérant soit une spécificité rétinienne dans les mécanismes contrôlant l’angiogenèse, soit l’intervention d’autres molécules pro-angiogéniques dans la DMLA. Dans l’œil intact, la sécrétion polarisée du VEGF par l’épithélium pigmentaire pourrait jouer un rôle important dans la maintenance d’une structure choriocapillaire normale et fonctionnelle [Blaauwgeers et al., 1999].
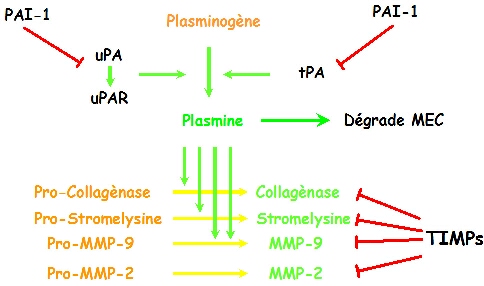
L’angiogenèse est un processus invasif qui requiert la protéolyse de la matrice extracellulaire, la prolifération et la migration des cellules endothéliales avec une synthèse simultanée de nouveaux composants matriciels. De tels évènements migratoires et de remaniements matriciels sont régulés par différents systèmes protéolytiques comprenant les métalloprotéinases matricielles (MMPs) et les protéinases à sérine du système du plasminogène/activateur du plasminogène.
Afin d’évaluer le rôle joué par PAI-1 dans l’angiogenèse pathologique sous-rétinienne, nous avons induit une néovascularisation choroïdienne in vivo à l’aide d’un laser à l’argon [Tobe et al., 1998] chez des souris déficientes pour le PAI-1 et des souris sauvages contrôles.
Des concentrations mesurables de tPA et de PAI ont été détectées dans de précédentes études cliniques dans l’humeur aqueuse d’yeux normaux [Smalley et al., 1994;Steinkamp et al., 1993]. Comme PAI-1 inhibe indirectement l’activation des MMPs, il est logique de penser que PAI-1 diminuerait la néovascularisation choroïdienne. Effectivement dans la rétinopathie du prématuré, le traitement par des doses élevées de PAI-1 exogène protège de la néovascularisation rétinienne [Penn and Rajaratnam, 2003;Penn et al., 2001].
Paradoxalement, nos résultats démontrent qu’une expression minimale de PAI-1 est nécessaire pour l’angiogenèse choroïdienne. L’effet du PAI-1 est restreint à la néovascularisation tumorale et oculaire pathologique, mais n’est pas observé dans la placentation, le développement embryonnaire et la réaction de cicatrisation, qui sont essentiellement normaux chez les souris déficientes pour le PAI-1 [Bajou et al., 2001].
Bien que le mécanisme d’action de PAI-1 reste à élucider, au moins trois hypothèses peuvent être formulées.
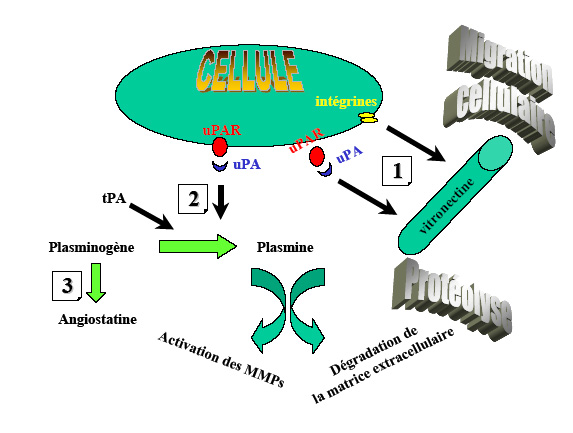
Le PAI-1 pourrait prévenir une dégradation excessive de la matrice contre la protéolyse médiée par l’uPA. De cette façon, il fournirait un substrat d’adhésion cellulaire pour la migration des cellules endothéliales. Il a été démontré in vitro qu’une protéolyse excessive empêche l’assemblage coordonné des cellules endothéliales en capillaires [Montesano et al., 1990].
Le PAI-1 pourrait jouer le rôle d’un déclencheur moléculaire qui gouvernerait l’adhésion et le décrochage des cellules par le biais de l’uPA et/ou d’intégrines [Noel et al., 1999;Czekay et al., 2003;Devy et al., 2002].
Le PAI-1 pourrait également promouvoir l’angiogenèse par une diminution de la production d’angiostatine par le plasminogène, grâce à son inhibition de la plasmine, de l’uPA et du tPA [Gately et al., 1997].
Pour conclure, la néovascularisation choroïdienne induite par laser chez la souris est un modèle de recherche fondamentale très utile dans le cadre de l’angiogenèse choroïdienne, bien que ce modèle diffère des évènements naturels se déroulant lors de la DMLA. Nos observations renforcent l’idée du rôle essentiel joué par le PAI-1 dans le développement de la néovascularisation sous-rétinienne et identifie clairement le PAI-1 comme une cible thérapeutique potentielle dans l’élaboration de stratégies thérapeutiques pour la lutte contre l’angiogenèse sous-rétinienne.
2) Nous avons donc montré l’importance de l’expression de PAI-1 dans la néovascularisation choroïdienne [Lambert et al., 2001]. Comme il a été rapporté que la présence de fibrine était une constante dans les membranes néovasculaires de la DMLA [Lopez et al., 1991;Lopez et al., 1993], nous avons étendu notre étude à l’expression et l’activité des autres membres du système fibrinolytique chez l’homme et dans la néovascularisation choroïdienne induite au laser chez la souris.
Nos données montrent pour la première fois l’expression des ARN messagers du tPA, de l’uPA et de l’uPAR aussi bien dans les membranes néovasculaires humaines extraites chirurgicalement que dans les membranes néovasculaires murines expérimentales. Ceci suggère, mais ne prouve pas définitivement, que ces molécules sont impliquées dans le processus de néovascularisation humaine, d’autant plus qu’une expression basale de ces molécules est aussi présente dans l’œil intact, plus principalement dans le complexe formé par l’épithélium pigmentaire et la choroïde. Ces observations étendues à la souris par immunolocalisation et zymographie in situ, montrent une activité des activateurs du plasminogène sur le site du trauma induit par laser. Nous avons dès lors recherché l’influence de l’absence des acteurs du système plasminogène/activateurs du plasminogène sur le développement expérimental de la néovascularisation choroïdienne.
Les souris sauvages contrôles et déficientes pour l’uPAR montrent une réponse angiogénique forte. Il n’y a pas de développement conséquent de la néovascularisation expérimentale chez les souris déficientes pour l’uPA, pour le tPA et le Plg, suggérant une contribution de ces protéases dans l’altération chorio-rétinienne. En effet, il a été démontré que la choroïde intacte est une source de sécrétion continue de tPA [Wang et al., 1995], et l’épithélium pigmentaire une source pour l’uPA [Hackett and Campochiaro, 1993]. L’activité urokinase est augmentée dans la néovascularisation rétinienne expérimentale et dans les membranes néovasculaires diabétiques [Das et al., 1999a;Das et al., 1999b]. Un taux intra-oculaire élevé de tPA a été associé avec la rétinopathie diabétique proliférative [Hattenbach et al., 1999] et des observations préliminaires ont suggéré qu’une inhibition de l’uPA peut prévenir la néovascularisation rétinienne induite par hypoxie (Mcguire PG,Jones TR, Talaric N, Warren E, Das A, ARVO Abstract 1261, 2002). L’absence d’effet secondaire de la déficience en uPAR pourrait être expliquée par le fait que la liaison de l’uPA sur l’uPAR n’est pas requise pour fournir une protéolyse péri-cellulaire suffisante de la plasmine médiée par l’uPA [Carmeliet et al., 1998].
Le phénotype observé chez les souris uPA-/-, tPA-/- et Plg-/- ne peut être imputé directement à une déficience au niveau endothélial. En effet, premièrement, la néovascularisation choroïdienne n’est pas une maladie exclusivement causée par la prolifération de cellules endothéliales pathologiques isolées. Des données cliniques [Grossniklaus et al., 2000] et expérimentales comme nous le montrerons dans le point 1) consacré aux MMPs, ont montré la présence d’une composante inflammatoire importante dans la maladie suggérant que la néovascularisation choroïdienne est une réponse non-spécifique de cicatrisation [Spraul et al., 1999]. Deuxièmement, des études précédentes ont montré que la migration des cellules endothéliales dans un gel de fibrine n’est pas sévèrement altérée par la déficience isolée d’un composant du système plasminogène/activateurs du plasminogène, mais que la MT1-MMP active est essentielle [Hiraoka et al., 1998]. Le fait que la déficience en uPA et en tPA endogènes n’altère pas la migration des cellules endothéliales a été confirmée dans un modèle d’anneaux d’aorte [Devy et al., 2002] et dans un modèle d’angiogenèse tumorale induite par l’implantation de kératinocytes malins [Bajou et al., 2001]. Pourtant, l’angiogenèse dans ces deux modèles est toujours dépendante de la présence de plasminogène, indiquant que la protéolyse médiée par la plasmine est un évènement clé à prendre en compte lors de la mise au point d’expériences particulières.
Dans cette étude, en absence d’uPA, de tPA ou de Plg, une accumulation excessive de fibrinogène/fibrine prend place au niveau du trauma induit par laser, en même temps que la présence d’une activité de type MMP. Ce dépôt de fibrine peut agir comme une barrière physique pour certains composants de la néovascularisation normale tels que les cellules endothéliales, les fibroblastes ou les monocytes. Ce bouchon ne peut être éliminé à temps sans fibrinolyse médiée par la plasmine.
Les capillaires choroïdiens formant des membranes néovasculaires pathologiques apparaissent extrêmement sensibles aux variations de l’équilibre protéolytique sous la conduite des activateurs du plasminogène. L’excès de fibrinolyse, comme chez les souris PAI-1-/-, ou le défaut de fibrinolyse, comme chez les souris déficientes pour le plasminogène ou les activateurs du plasminogène, peuvent tous deux prévenir le développement néovasculaire, et peuvent être proposés, à condition d’un contrôle approprié, comme une stratégie anti-angiogénique pharmacologique.
3) Certains résultats expérimentaux montrent un effet inhibiteur de l’angiogenèse avec de haut taux de PAI-1, ce qui semble paradoxal. Ainsi, des cellules tumorales transfectées par de l’ADNc de PAI-1 engendrent une diminution de la croissance des tumeurs primaires et de l’angiogenèse associée aux tumeurs [Soff et al., 1995]. L’effet inhibiteur des stéroïdes angiostatiques sur la néovascularisation a été attribué à une diminution de l’expression de l’uPA et une augmentation de l’expression du PAI-1 [Penn et al., 2001;Blei et al., 1993;DeFaller and Clark, 2000]. Un de ces composés, l’anécortave d’acétate, diminue la néovascularisation choroïdienne humaine et est testé en phase clinique II et III impliquant des centaines de patients [D'Amico et al., 2003]. Curieusement, de faibles doses (15 mg en intra-oculaire) semblent efficaces alors que de plus fortes doses (30 mg injecté) sont inefficaces [Soubrane et al., 2002]. Une courbe dose-réponse biphasique de PAI-1 a été observée dans des modèles in vitro (anneaux d’aortes) et in vivo (matrigel dans le CAM assay) [Devy et al., 2002;Stefansson et al., 2001;McMahon et al., 2001].
Une explication de ces résultats conflictuels est que le PAI-1 pourrait avoir une rôle pro- ou anti-angiogène en fonction de sa concentration. La vérification de cette hypothèse a fait l’objet de cette étude.
Le profil d’expression spatio-temporel de l’ARN messager de PAI-1 mis en évidence dans ce travail est en accord avec les observations précédentes démontrant une induction de l’expression de PAI-1 dans les cellules endothéliales en migration, une expression limitée à l’épithélium ciliaire dans les yeux intacts de rongeurs et avec nos résultats précédents d’immunolocalisation de PAI-1 dans les bourgeons néovasculaires choroïdiens [Lambert et al., 2001;Pepper et al., 1992;Masos et al., 2000].
L’expression consistante de PAI-1 dans les membranes néovasculaires humaines tendrait à soutenir le rôle joué par PAI-1 pendant la progression de la forme exsudative de la DMLA. Cliniquement, un taux élevé de PAI-1 a été mis en évidence dans les rétinopathies diabétiques humaines, alors que des taux minimums sont observés dans les rétines normales [Grant et al., 1996].
A notre connaissance, ce travail est le premier montrant un effet clair de l’effet dose-réponse de PAI-1 sur l’angiogenèse dans un modèle pathologique chorio-rétinien. En testant diverses concentrations de PAI-1 recombinants actifs en injections intra-péritonéales, nous avons fourni des preuves des effets opposés de PAI-1 pendant le développement néovasculaire choroïdien. PAI-1 a un comportement pro-angiogénique aux faibles concentrations et une action anti-angiogénique aux plus fortes concentrations. Ces affirmations sont étayées par les observations suivantes :
- Le développement néovasculaire choroïdien est inhibé chez les souris PAI-1-/- [Lambert et al., 2001].
- La formation du bourgeon néovasculaire est restaurée chez les souris PAI-1-/- par l’injection de protéine PAI-1 recombinante, et la restauration est proportionnelle à la dose injectée.
- L’injection de fortes doses de PAI-1 recombinant (100 µg/jour) aux souris sauvages inhibe significativement le développement néovasculaire.
Ces données sont en parfait accord avec celles obtenues sur le modèle des anneaux aortiques montrant l’effet pro-angiogénique de PAI-1 au concentrations physiologiques (de l’ordre du nanomolaire) et son effet anti-angiogénique aux plus fortes concentrations [Devy et al., 2002 Bajou et al., 2004b]. La co-localisation de l’uPA et du PAI-1 dans les cellules endothéliales migrantes [Pepper et al., 1992] et dans les cellules tumorales [Liu et al., 1995] met en évidence l’importance de la production simultanée des protéases et de leurs inhibiteurs, et conduit au concept de « balance protéolytique ». En protégeant la matrice extracellulaire d’une dégradation excessive, le PAI-1 peut stabiliser l’échafaudage matriciel nécessaire à la migration des cellules endothéliales et à l’assemblage coordonné de ces cellules en capillaires [Pepper and Montesano, 1990]. En association avec les autres glycoprotéines adhésives, les dépôts de fibrinogène/fibrine servent d’échafaudage afin d’aider au maintien des liaisons avec les facteurs de croissance. Ces dépôts aident également la réponse cellulaire pour l’adhésion, la prolifération et la migration pendant l’angiogenèse [Simpson-Haidaris and Rybarczyk, 2001]. Les intenses modulations dans les dépôts de fibrinogène/fibrine induites par les variations du taux de PAI-1 ont été démontrées par immunolocalisation dans notre modèle de néovascularisation expérimentale.
Nos résultats peuvent ainsi expliquer, au moins en partie, l’efficacité dose-dépendante de certains médicaments tel que l’anécortave acétate, déjà testé en phase clinique contre la forme exsudative de la DMLA. L’augmentation du dosage de cet agent permet une augmentation locale de l’expression de PAI-1 sans toutefois atteindre les taux suffisament élevés que pour inhiber l’angiogenèse. Il est donc logique d’observer que des plus hautes doses d’anécortave (30mg) sont moins efficaces comparées à l’utilisation du placebo ou à des doses plus basses [Soubrane et al., 2002].
L’existence d’une courbe biphasique dose-réponse met, de façon plus générale, en garde contre les stratégies pharmacologiques incontrôlées dans lesquelles les agonistes et les antagonistes de PAI-1 sont utilisés pour l’inhibition de la néovascularisation [Calabrese, 2001].