
University of Liège,
Pathology Tower (BC-3), Sart-Tilman, B-4000 Liège, BELGIUM
Phone : +32-4-366.72.75
Fax : +32-4-366.29.36

|
University of Liège, Pathology Tower (BC-3), Sart-Tilman, B-4000 Liège, BELGIUM Phone : +32-4-366.72.75 Fax : +32-4-366.29.36 |
Résumé de la thèse de doctorat en Sciences Biomédicales de Vincent LAMBERT défendue le 8 juillet 2005 à l'Université de Liège, Belgique
Ce travail a été réalisé au sein du
Dans le premier chapitre du travail consacré à l’étude de l’intervention des protéases à sérine dans la néovascularisation choroïdienne, nous avons montré que :
- PAI-1, uPA, tPA et uPAR sont exprimés à la fois dans les membranes néovasculaires humaines et expérimentales;
- une protéolyse excessive (par absence de PAI-1) ou déficiente (par excès de PAI-1, ou par inactivation de uPA, tPA ou Plg) empêchent toutes deux le développement de la réaction néovasculaire dans la choroïde;
- l’effet de PAI-1 sur le processus néovasculaire est pro-angiogène ou anti-angiogène en fonction de la dose étudiée, et s’exerce par le contrôle de l’activité fibrinolytique d’avantage qu’au travers des interactions avec la vitronectine;
- l’absence d’uPA, tPA ou Plg entraîne une accumulation de fibrinogène/fibrine dans les lésions induites par le laser.
Le rôle essentiel joué par PAI-1 dans l’angiogenèse pathologique choroïdienne peut s’expliquer par le caractère multifonctionnel de cette molécule. Bien que les mécanismes d’action de PAI-1 restent à préciser, au moins deux théories peuvent être proposées. La première suggère qu’en protégeant la matrice extra-cellulaire d’une dégradation excessive, PAI-1 permettrait de stabiliser la matrice, qui agit tel un échafaudage nécessaire à la migration des cellules endothéliales et à l’assemblage de ces cellules endothéliales en capillaires [Pepper and Montesano, 1990]. Le retard d’angiogenèse, observé en absence de plasminogène, conforte également l’importance d’un contrôle précis de la protéolyse médiée par la plasmine [Bajou et al., 2001]. De plus, la séquestration de PAI-1 au sein de la matrice extra-cellulaire est compatible avec un tel rôle. Donc, un équilibre précis entre les enzymes protéolytiques et leurs inhibiteurs semble être essentiel à la migration des cellules endothéliales et à leur différenciation en vaisseaux fonctionnels. Dans un modèle d’anneaux d’aortes, aucun vaisseau n’a été formé à partir d’animaux déficients pour le PAI-1. L’ajout de PAI-1 recombinant exogène, à des concentrations physiologiques, permet de nouveaux le bourgeonnement des micro-vaisseaux, tandis que l’usage de concentrations dites thérapeutiques inhibe l’angiogenèse [Devy et al., 2002]. De façon similaire, le PAI-1 inhibe l’angiogenèse induite par le bFGF, lorsqu’il est employé à fortes concentrations [Stefansson et al., 2001]. PAI-1 inhibe également l’angiogenèse pathologique dans un modèle de rétinopathie du prématuré chez le rat [Penn and Rajaratnam, 2003]. Le PAI-1 semble donc avoir une dualité de fonction arborant une activité pro-angiogénique à des concentrations physiologiques, et des effets anti-angiogéniques à de hautes concentrations dites pharmacologiques[Bajou et al., 2004b].
Le second mécanisme d’action de PAI-1 durant l’angiogenèse peut être mis en relation avec sa capacité à interagir avec l’uPAR, les intégrines, et la vitronectine, et, par conséquent, de contrôler la migration cellulaire. Lorsque le PAI-1 est lié à la vitronectine [Zhou et al., 2003;Czekay et al., 2003], le site d’adhésion des intégrines devient cryptique et l’adhésion cellulaire est bloquée. Toutefois, l’expression de l’uPA compense l’effet d’anti-adhésion du PAI-1, en déstabilisant l’interaction entre la vitronectine et le PAI-1. La liaison de l’uPAR et de la vitronectine pourra, dès lors, avoir cours à nouveau et permettra l’accès des intégrines cellulaires sur les sites d’adhésion RGD. En tenant compte du concept selon lequel la migration cellulaire est considérée comme une succession d’attachements et de détachements, l’effet du PAI-1 pourrait donc être vu comme de type migratoire [Stefansson and Lawrence, 2003;Czekay and Loskutoff, 2004;Degryse et al., 2004].
Afin d’élucider le mécanisme d’action de PAI-1, des adénovirus ont été utilisés dans le but de délivrer deux formes mutantes de PAI-1 à des souris déficientes pour le PAI-1, dans le modèle de transplantation cité plus haut [Bajou et al., 2001] et, dans un modèle d’anneaux aortiques [Devy et al., 2002]. Les PAI-1 mutants, soit ont gardé une liaison normale à la vitronectine, mais ne peuvent plus inhiber l’uPA ou le tPA, soit inhibent normalement les activateurs du plasminogène, mais ont une liaison sur la vitronectine négligeable. Dans les deux modèles, aussi bien in vivo, qu’in vitro, l’angiogenèse est restaurée uniquement par le PAI-1 mutant ayant conservé son activité inhibitrice des activateurs du plasminogène intacte, démontrant que le besoin de PAI-1 est lié à sa capacité d’inhiber une protéolyse excessive plutôt que d’interagir avec la vitronectine. En accord avec ces données, l’angiogenèse et l’invasion tumorale ont été aussi bien observées chez des souris déficientes pour la vitronectine que dans le groupe témoin [Bajou et al., 2001]. Dans une étude séparée utilisant les PAI-1 mutants, l’inhibition de l’angiogenèse induite par le bFGF dans un modèle de membrane chorïo-allantoïde d’embryon de poulet requiert aussi bien l’activité anti-protéinasique que la capacité de liaison à la vitronectine du PAI-1 [Stefansson et al., 2001]. Toutes ces données suggèrent que, suivant la situation, PAI-1 peut contrôler l’angiogenèse en régulant les évènements protéolytiques et/ou non-protéolytiques dans la migration des cellules endothéliales [Stefansson et al., 2003].
Le corollaire de ces recherches est que l’utilisation de PAI-1 en tant que cible thérapeutique peut s’avérer hasardeuse et dangereuse. Nos résultats peuvent en partie expliquer l’efficacité dose-dépendante de médicaments, tel que l’anécortave acétate, et mettre en garde contre des stratégies pharmacologiques incontrôlées dans lesquelles les agonistes et antagonistes de PAI-1 sont utilisés pour l’inhibition de la néovascularisation choroïdienne et pour lesquelles existe une courbe biphasique dose-réponse.
Dans le chapitre consacré à l’étude de l’influence des métalloprotéinases, nous montrons que :
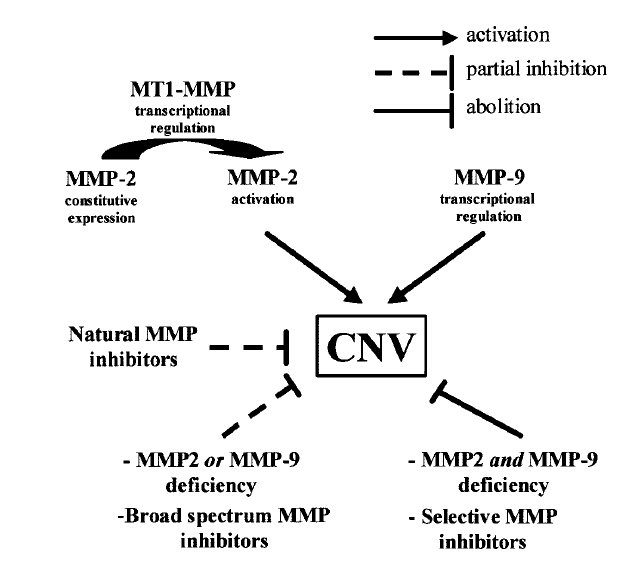
- le profil d’apparition et d’expression de la MMP-9 dans la lésion ressemble au profil observé au cours de la cicatrisation et coïncide avec l'arrivée des monocytes dans la lésion;
- l’absence de MMP-9 réduit l’importance de la réaction néovasculaire;
- l’inactivation combinée de la MMP-2 et de la MMP-9 prévient le développement de la néovascularisation choroïdienne plus efficacement que la déficience isolée d’un des gènes;
- l'activation du zymogène pro-MMP-2 est la conséquence d'une surexpression de MT1-MMP;
- un inhibiteur naturel ou synthétique de métalloprotéinases peut prévenir ou entraîner une régression partielle des néovaisseaux choroïdiens.
Nous avons ainsi montré qu’une modulation contrôlée de l’activité protéolytique pouvait mener à l’inhibition de l’angiogenèse. Un traitement expérimental utilisant un dérivé innovant, inhibiteur sélectif de l’activité de certaines MMPs [Maquoi et al., 2004], s’est montré particulièrement efficace dans notre modèle. Ces observations ouvrent donc la voie à une stratégie combinant des molécules intervenant à différentes étapes de la néovascularisation choroïdienne.
En conclusion, nos travaux pourront ouvrir de nouvelles perspectives thérapeutiques, en association avec d’autres traitements et de nouvelles technologies, dans le cadre de la lutte contre la dégénérescence maculaire liée à l’âge aussi bien sur le plan curatif que préventif.